Le monde du vivant arbore une infinie diversité de formes et de tailles à l’échelle des organismes entiers et cette diversité participe à notre émerveillement pour la nature. Néanmoins, l’existence de cette diversité ne repose pas sur des critères esthétiques mais bien sur des contraintes fonctionnelles. Il en va ainsi du cou de la girafe, pour atteindre les feuilles les plus hautes, ou des nageoires du poisson volant mimant l’aile des oiseaux. La même diversité de formes, reposant sur les mêmes contraintes fonctionnelles, existe aussi à l’échelle de nos organes. Par exemple, l’arborescence de nos poumons maximise la surface d’échange entre l’air et le sang pour faciliter les échanges gazeux. Il est donc important de comprendre comment nos gènes sculptent ces organes en une forme spécifique (morphogenèse) et avec une taille appropriée (croissance). L’étude des mécanismes contrôlant croissance et morphogenèse repose sur des processus biologiques dynamiques multi-échelles (moléculaire, cellulaire et tissulaire) et nécessite des approches impliquant biologie du développement, génétique, biologie cellulaire et biophysique.
Outre ces aspects fondamentaux, notre thématique d’étude s’inscrit également dans des perspectives médicales puisque 80% des cancers ont une origine épithéliale et la dérégulation des mécanismes contrôlant leur croissance ou leur morphogenèse est impliquée dans le développement tumoral. De fait, plusieurs des gènes que nous étudions sont des suppresseurs de tumeur ou des oncogènes chez l'humain. De plus, certains de ces gènes sont aussi impliqués dans des myopathies chez l’homme – notamment le gène codant pour la dystrophine, impliqué dans les myopathies de Duchenne et de Becker - , et leur étude dans notre système apporte un jour nouveau sur leur implication dans ces maladies génétiques.
N
Financeurs

Recherche
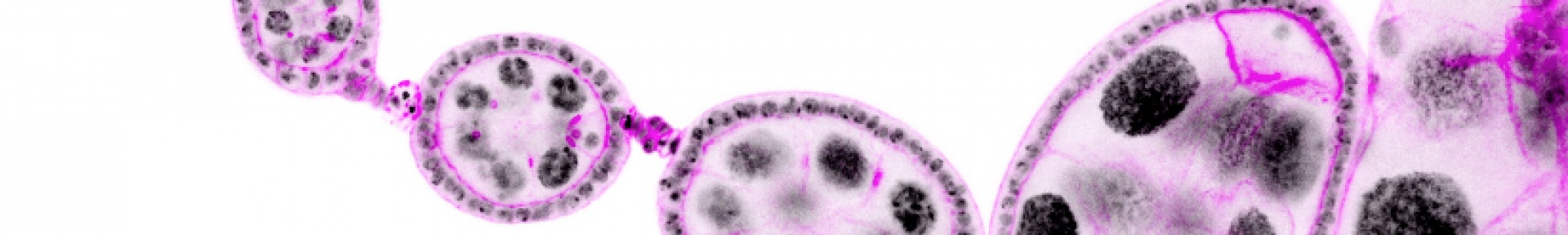
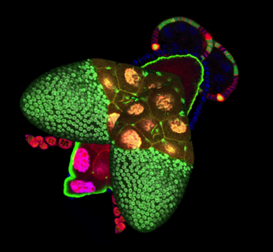
Les mécanismes contrôlant croissance et morphogenèse sont plus faciles à étudier au sein des épithéliums car les cellules épithéliales ont une forme relativement simple et très stéréotypée. Ainsi tout défaut de forme ou de taille est facilement observable et quantifiable. De plus, la majorité de nos organes sont constitués de ce type cellulaire, caractérisé par des cellules étroitement juxtaposées, polarisées, associées par des jonctions intercellulaires et qui reposent sur une lame basale. Nous avons choisi la drosophile (mouche du vinaigre) comme organisme modèle, pour les possibilités sans égal qu’elle offre en termes d’outils génétiques et d’imagerie cellulaire. Plus précisément, nous utilisons les cellules folliculaires des ovaires de drosophile comme modèle d’épithélium in vivo. L’épithélium folliculaire ovarien possède une morphologie très similaire aux épithéliums de mammifères et une croissance rapide mais strictement contrôlée. Anatomiquement, cet épithélium entoure la lignée de cellules germinales au sein de l’organe reproducteur, l’ensemble des cellules folliculaires et germinales constituant le ‘follicule ovarien’ ou ‘chambre d’œuf’, précurseur du futur œuf. L’élongation du follicule ovarien, qui passe progressivement au cours de sa maturation d’une forme sphérique à une forme allongée, est engendrée par l’épithélium folliculaire.
Ainsi, les projets développés au sein de l’équipe se concentrent autour de deux axes :
1 Comprendre les mécanismes de coordination de la croissance entre deux tissus adjacents. Pour cela, nous analysons les modes de communication entre les cellules épithéliales folliculaires et les cellules germinales qu’elles entourent permettant la synchronisation de leur croissance au cours du développement des follicules ovariens et assurer ainsi l’homéostasie de l’organe reproducteur.
2 Élucider les mécanismes morphogénétiques conduisant à l’élongation des follicules ovarien. Nous étudions d’une part la dynamique et l’implication du cytosquelette d’actine aux niveaux des jonctions cellulaires apicales de l’épithélium folliculaire, situées en contact avec les cellules germinales, dans l’élongation précoce des follicules. D’autre part, nous analysons le rôle du complexe protéique Dystrophine-Dystroglycan et du domaine basal de l’épithélium dans l’élongation plus tardive des follicules ovariens et notamment dans la polarité planaire et l’organisation de la matrice extracellulaire.
Si notre recherche vous intéresse, n’hésitez pas à nous contacter pour envisager les possibilités de joindre notre équipe (financement thèse ou postdoc, concours ou mobilité chercheur).
Membres
Publications
Gap junctions allow transfer of metabolites between germ cells and somatic cells to promote germ cell growth in the Drosophila ovary.
Publié le 18 Fév 2025 dans PLoS biology , vol. 23 - pp e3003045
Vachias C , Tourlonias C , Grelée L , Gueguen N , Renaud Y , Venugopal P , Richard G , Pouchin P , Brasset E , Mirouse V
The Dystrophin-Dystroglycan complex ensures cytokinesis efficiency in Drosophila epithelia.
Publié le 15 Nov 2024 dans EMBO reports
Gonçalves M, Lopes C, Alégot H , Osswald M, Bosveld F, Ramos C, Richard G , Bellaiche Y, Mirouse V , Morais-de-Sá E
The transcription factor Traffic jam orchestrates the somatic piRNA pathway in Drosophila ovaries
Publié le 12 Sep 2024 dans bioRxiv
Alizada A*, Martins A* , Mouniée N* , Rodriguez Suarez JV*, Bertin B , Gueguen N , Mirouse V , Maupetit-Mehouas S , Rivera AJ, Lau NC, Hannon GJ, Czech Nicholson B, Brasset E.
Basement membrane diversification relies on two competitive secretory routes defined by Rab10 and Rab8 and modulated by dystrophin and the exocyst complex.
Publié le 04 Mar 2024 dans PLoS genetics , vol. 20 - pp e1011169
Evolution and developmental functions of the dystrophin-associated protein complex: beyond the idea of a muscle-specific cell adhesion complex.
Publié le 13 Juin 2023 dans Frontiers in cell and developmental biology , vol. 11 - pp 1182524
In preprints: get to know your neighbours – cell interface surveillance through a molecular zip code.
Publié le 15 Avr 2023 dans Development (Cambridge, England) , vol. 150
Ríos-Barrera LD, Mirouse V
Multiple functions of the scaffold protein Discs large 5 in the control of growth, cell polarity and cell adhesion in Drosophila melanogaster.
Publié le 18 Juin 2020 dans BMC developmental biology , vol. 20 - pp 10
Venugopal P , Veyssière H , Couderc JL , Richard G , Vachias C , Mirouse V
Sequential Ras/MAPK and PI3K/AKT/mTOR pathways recruitment drives basal extrusion in the prostate-like gland of Drosophila.
Publié le 08 Mai 2020 dans Nature communications , vol. 11 - pp 2300
Rambur A , Lours-Calet C, Beaudoin C , Buñay J, Vialat M , Mirouse V , Trousson A , Renaud Y , Lobaccaro JA, Baron S , Morel L , de Joussineau C
Oriented basement membrane fibrils provide a memory for F-actin planar polarization via the Dystrophin-Dystroglycan complex during tissue elongation.
Publié le 08 Avr 2020 dans Development (Cambridge, England) , vol. 147
Cerqueira Campos F , Dennis C , Alégot H , Fritsch C , Isabella A, Pouchin P , Bardot O , Horne-Badovinac S, Mirouse V
Jak-Stat pathway induces Drosophila follicle elongation by a gradient of apical contractility.
Publié le 08 Fév 2018 dans eLife , vol. 7
Drosophila LKB1 is required for the assembly of the polarized actin structure that allows spermatid individualization.
Publié le 02 Août 2017 dans PloS one , vol. 12 - pp e0182279
Comparative genomics highlights the unique biology of Methanomassiliicoccales, a Thermoplasmatales-related seventh order of methanogenic archaea that encodes pyrrolysine.
Publié le 13 Août 2014 dans BMC genomics , vol. 15 - pp 679
Borrel G, Parisot N, Harris HM, Peyretaillade E, Gaci N, Tottey W, Bardot O , Raymann K, Gribaldo S, Peyret P, O'Toole PW, Brugère JF
ScientiFig: a tool to build publication-ready scientific figures.
Publié le 30 Nov 2013 dans Nature methods , vol. 10 - pp 1048
Genome Sequence of « Candidatus Methanomassiliicoccus intestinalis » Issoire-Mx1, a Third Thermoplasmatales-Related Methanogenic Archaeon from Human Feces.
Publié le 11 Juil 2013 dans Genome announcements , vol. 1
Borrel G, Harris HM, Parisot N, Gaci N, Tottey W, Mihajlovski A, Deane J, Gribaldo S, Bardot O , Peyretaillade E, Peyret P, O'Toole PW, Brugère JF
PTEN controls junction lengthening and stability during cell rearrangement in epithelial tissue.
Publié le 10 Juin 2013 dans Developmental cell , vol. 25 - pp 534-46
Bardet PL, Guirao B, Paoletti C, Serman F, Léopold V, Bosveld F, Goya Y, Mirouse V , Graner F, Bellaïche Y
Tissue-specific function of Patj in regulating the Crumbs complex and epithelial polarity.
Publié le 30 Déc 2012 dans Development (Cambridge, England) , vol. 139 - pp 4549-54
Pénalva C, Mirouse V
DroPNet: a web portal for integrated analysis of Drosophila protein-protein interaction networks.
Publié le 30 Juil 2012 dans Nucleic acids research , vol. 40 - pp W134-9
Renaud Y , Baillif A, Perez JB, Agier M, Mephu Nguifo E, Mirouse V
The LKB1/AMPK polarity pathway.
Publié le 06 Avr 2011 dans FEBS letters , vol. 585 - pp 981-5
Mirouse V , Billaud M
A two-step Notch-dependant mechanism controls the selection of the polar cell pair in Drosophila oogenesis.
Publié le 30 Août 2010 dans Development (Cambridge, England) , vol. 137 - pp 2703-11
Vachias C , Couderc JL , Grammont M
Bazooka is required for polarisation of the Drosophila anterior-posterior axis.
Publié le 30 Mai 2010 dans Development (Cambridge, England) , vol. 137 - pp 1765-73
Doerflinger H, Vogt N, Torres IL, Mirouse V , Koch I, Nüsslein-Volhard C, St Johnston D
aPKC phosphorylation of Bazooka defines the apical/lateral border in Drosophila epithelial cells.
Publié le 30 Avr 2010 dans Cell , vol. 141 - pp 509-23
Morais-de-Sá E, Mirouse V , St Johnston D